- Argomento
- Scienza e Tecnologia
Sistemi terapeutici innovativi e ingegneria tissutale. La collaborazione transfrontaliera che dà buoni frutti
L’obiettivo di ATEx, finanziato nell’ambito del Programma di Cooperazione INTERREG V-A Italia-Svizzera 2014-2020, è stato descrivere lo sviluppo di nuovi prodotti e servizi che combinassero biomateriali evoluti, scaffold, dispositivi medici, cellule staminali e loro derivati. Le applicazioni nell'ambito dell'ingegneria tissutale stanno già sfruttando le potenzialità del secretoma delle cellule staminali mesenchimali.
Di Lorena Segale, Andrea Foglio Bonda, Maria Luisa Torre, Marzio Sorlini e Giuseppe Perale
Autore Lorena Segale
Data di pubblicazione

credits © UPO/123RF
L’ingegneria tissutale, che prevede la combinazione di un supporto (biomateriali evoluti, scaffold naturali o sintetici), rappresenta un approccio promettente per il trattamento di molteplici patologie ad elevato impatto sociale. La ricerca in tale ambito (i così detti “Prodotti Medicinali per le Terapie Avanzate”) risulta trasversale a molte patologie e trova potenziale ed effettiva applicazione in svariati ambiti (osseo, cartilagineo ed epiteliale). Tuttavia ad oggi, restano ancora alcune limitazioni di carattere sia tecnico che normativo/regolatorio da superare prima di un pieno utilizzo di tali soluzioni in ambito clinico.
Le terapie avanzate, sfruttando in particolare la combinazione di biomateriali di varia origine (animale od umana) con cellule staminali o loro derivati (secretoma), stanno mostrando il loro notevole potenziale terapeutico e perciò svariati soggetti pubblici e privati stanno lavorando da alcuni anni sul loro sviluppo. Le problematiche da affrontare sono molteplici: dalla selezione dei vari "ingredienti" che li costituiscono allo sviluppo di metodiche di produzione e standardizzazione opportune a superare i rigorosi requisiti di qualità di grado farmaceutico (le Good Manufacturing Practices o GMP).

Interregg Italia-Svizzera Interregg Italia-Svizzera
L’obiettivo del progetto ATEx, finanziato nell’ambito del Programma di Cooperazione INTERREG V-A Italia-Svizzera 2014-2020, è stato quello di descrivere lo sviluppo di nuovi prodotti/servizi che combinassero biomateriali evoluti, scaffold, dispositivi medici e cellule staminali e/o loro derivati.
Sono state definite nuove opportunità competitive destinate a specifiche aziende del territorio frontaliero e che rappresentassero, al tempo stesso, modelli d’ispirazione per altre iniziative simili; tale risultato è stato ottenuto unendo competenze provenienti da ambiti complementari nel contesto delle terapie avanzate, tramite esperienze strutturate di condivisione e trasferimento tecnologico.
Il progetto si è proposto di utilizzare le competenze dei partner coinvolti, promuovendo lo sviluppo di nuove soluzioni, individuando anche partner esterni in grado di occuparsi degli aspetti regolatori e del finanziamento e trasferendo in maniera sistematica e organica tali conoscenze al mercato. Il team di ATEx, composto da 6 partner (Dipartimento di Scienze del Farmaco, Università del Piemonte Orientale; APTSol s.r.l; Dipartimento di Scienze del Farmaco, Università degli Studi di Pavia; Daymed s.r.l; PharmaExceed s.r.l. e Industrie Biomediche Insubri – SA) vuole sviluppare risposte e fornire soluzioni attraverso lo sviluppo di progetti guida che possano essere utilizzati come modelli di nuove soluzioni per il mercato delle terapie avanzate.
Per poter portare a compimento tutte le attività previste, parte del tempo di progetto è stato dedicato quindi al design, alla realizzazione e allo studio approfondito di potenziali nuovi prodotti concentrando l’attenzione in particolare sulle cellule staminali mesenchimali (MSC) e sui loro derivati, che oggi giorno sono sempre più spesso oggetto di studi e ricerche. Nel dettaglio si è pensato di valutare il possibile impiego di secretoma da MSC, come sostanza terapeuticamente efficace, in un prodotto innovativo.
Il secretoma è un insieme di sostanze secrete dalle MSC (ad esempio fattori solubili come citochine, chemochine, fattori di crescita e vescicole extracellulari nano o microstrutturate insolubili), capace di riprodurre gli effetti terapeutici delle cellule staminali, implementandone al tempo stesso vantaggi e sicurezza. Il trasferimento, però, di questa terapia in ambito clinico resta una sfida dal momento che i tradizionali metodi di produzione del secretoma ne limitano l’applicabilità e rendono difficoltosa la valutazione circa la sua sicurezza ed efficacia ad alte dosi. Inoltre, affinché il secretoma possa essere impiegato in terapia è necessario che venga formulato in un prodotto standardizzato, che oltre ad essere di qualità, efficace e sicuro, deve essere facilmente maneggevole da parte degli utilizzatori finali. Partendo, quindi, da un metodo di produzione che combina ultrafiltrazione e liofilizzazione per trasformare il secretoma di MSC in un prodotto denominato lyosecretoma (Fig. 1), nel corso del progetto ATEx si è cercato di ottimizzare la formulazione innovativa. In particolare sono stati valutati i fattori responsabili della variabilità nella risposta terapeutica, in grado quindi di poter minare la robustezza del processo produttivo e successivamente si sono intraprese azioni al fine di ottenere un prodotto finito sempre più standardizzato.
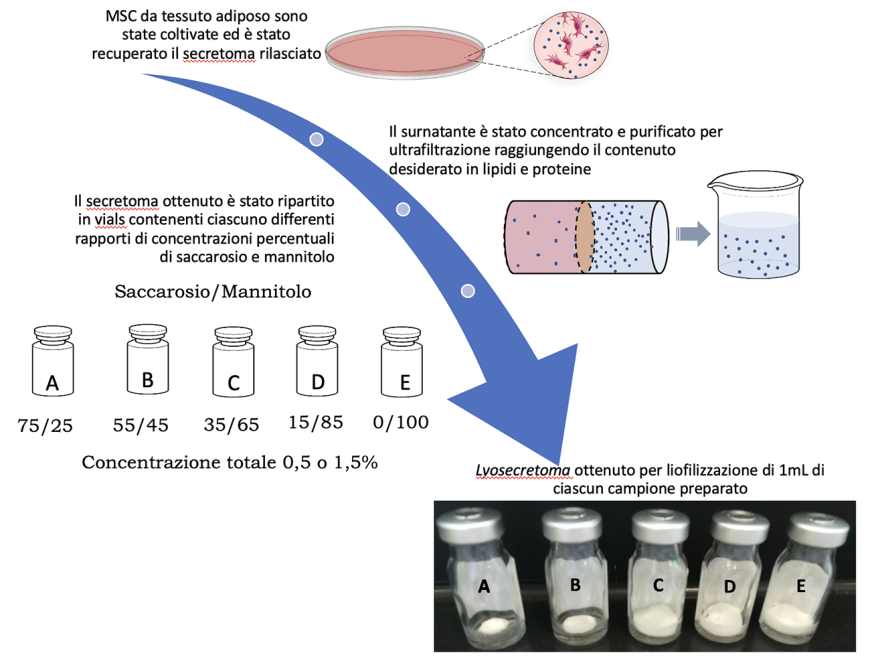
Figura 1 Figura 1. Schema di produzione con ultrafiltrazione e liofilizzazione per trasformare il secretoma di MSC in lyosecretoma
È stato studiato, attraverso l’uso di strumenti statistici (disegno sperimentale e analisi della componente principale), come alcuni fattori, quali il lotto di produzione, le condizioni adottate per la liofilizzazione, la concentrazione di eccipienti del prodotto liofilizzato e loro proporzioni, possano influenzare la qualità e la performance terapeutica del secretoma. In particolare è stato valutato l’impatto di queste variabili sulle caratteristiche tecnologiche del liofilizzato finale (aspetto e umidità residua) e sulla dimensione delle vescicole extracellulari che compongono il secretoma, sul suo contenuto in lipidi e proteine e sulla sua attività anti-elastasica in vitro. I risultati ottenuti dimostrano che, selezionati saccarosio e mannitolo come crioprotettori da includere nella formulazione per proteggere il materiale biologico dallo stress a cui si trova sottoposto durante il processo di liofilizzazione, il rapporto tra questi due eccipienti nella formulazione non influenza né l’umidità residua del prodotto né le dimensioni delle vescicole extracellulari del secretoma. Quando però il rapporto tra i due eccipienti è pari al 60% e la concentrazione totale in eccipienti nella formulazione si attesta intorno all’1,5%, il contenuto lipidico e proteico del lyosecretoma risulta maggiormente preservato. Diversamente, sembra che la presenza di solo mannitolo in concentrazione pari allo 0,5% sia garanzia del mantenimento dell’attività anti-elastasica in vitro.
Questo studio ha evidenziato, inoltre, che la causa principale di variabilità del prodotto finito è attribuibile alla qualità e alla composizione del secretoma iniziale. Per questo motivo si è pensato di modificare e validare il processo di produzione in modo da ottenere un secretoma concentrato in cui risultasse ben definito a priori il contenuto in lipidi e proteine. L’approccio adottato ha permesso di disporre di un prodotto finito maggiormente riproducibile in termini di composizione e attività biologica che lascia presagire il raggiungimento di un buon successo in fase di scale-up industriale.
Per indagare ancora più da vicino la possibilità reale di impiegare il lyosecretoma a scopo terapeutico, le attività del progetto ATEx si sono concentrate sulla sua utilizzazione nell’ambito della medicina rigenerativa, in particolare per arricchire innesti ossei (SmartBone®) commercializzati da circa 10 anni dal Capofila svizzero del progetto (Industrie Biomediche Insubri – SA), al fine di controllare il rilascio in vivo di fattori paracrini dalle MSC.
SmartBone® è un sostituto osseo innovativo, classificato come dispositivo medico di classe III, impiegato per la rigenerazione ossea nella chirurgia ricostruttiva (orale, maxillofacciale, ortopedica e oncologica). Nell’ambito del progetto ATEx è stata valutata una nuova strategia per aumentare l’attività osteoinduttiva di SmartBone®, caricando gli scaffold ossei con lyosecretoma, ovvero con una formulazione liofilizzata di secretoma derivato da MSC.
La formulazione del lyosecretoma, ottimizzata per garantire uno specifico e adeguato contenuto di proteine e endovescicole nello scaffold, è stata caricata su questo per adsorbimento. Sugli scaffold arricchiti sono state eseguite analisi morfologiche, è stato valutato il contenuto effettivo in lyosecretoma e la capacità del sistema di rilasciarlo. Inoltre, sono stati eseguiti studi per dimostrare l’abilità dello scaffold arricchito di indurre la formazione di nuovo tessuto osseo sano.
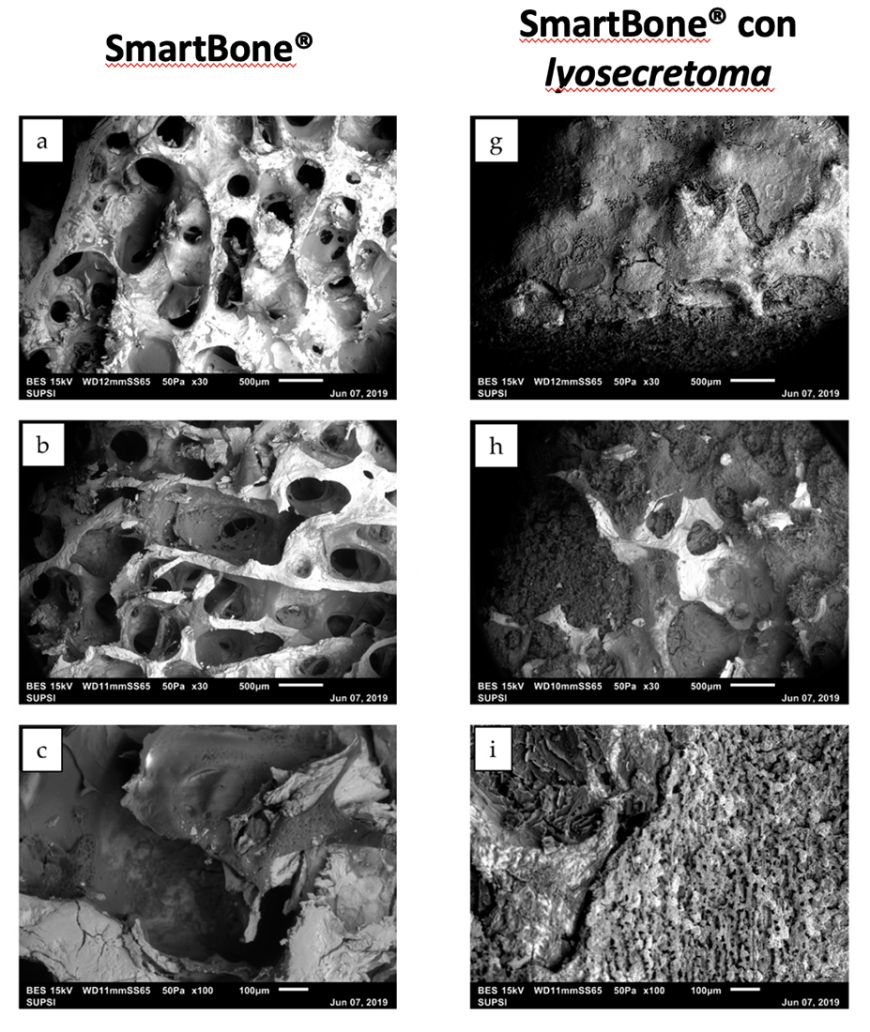
Figura 2 Figura 2. Immagini SEM di SmartBone® (a-c) e di SmartBone® arricchito (g-i), ingrandimenti da 30× and 100× e scale bar: 500 and 100 µm. Le immagini al microscopio evidenziano il corretto funzionamento di lyosecretoma.
L’analisi morfologica del sistema prodotto effettuata mediante microscopia elettronica a scansione ha evidenziato come la formulazione di lyosecretomaottimizzatasisiadepositatauniformemente sulla superficie del supporto osseo, andando a chiudere completamente i pori originariamente presenti nella sua struttura (Fig. 2). Gli studi di rilascio in vitro hanno dimostrato che, dopo 14 giorni, vi è un aumento significativo della proliferazione cellulare quando SmartBone® era caricato con lyosecretomarispettoaquandoèstato testato tal quale. Inoltre, lo scaffold arricchito ha mostrato una maggior capacità di espressione dei marcatori di osteoblasti e la presenza di una maggiore quantità di trabecole di nuova formazione, ad indicare la maggior capacità di questo sistema innovativo di indurre la rigenerazione ossea.
La strategia adottata si è, dunque, dimostrata vincente e vantaggiosa per sfruttare le potenzialità del secretoma di MSC in un prodotto innovativo per la medicina rigenerativa.
Bibliografia
1. Mocchi M., Bari E., Marrubini G., Foglio Bonda A., Perteghella S., Tartara F., Cofano F., Di Perna G., Giovannelli L., Mandracchia D., Sorlini M., Garbossa D., Torre M.L., Segale L. Freeze-dried mesenchymal stem cell-secretome pharmaceuticalization: optimization of formulation and manufacturing process robustness. Pharmaceutics 2021, 13, 1129.
2. Bari E., Roato I., Perale G., Rossi F., Genova T., Mussano F., Ferracini R., Sorlini M, Torre M.L., Perteghella S. Biohybrid bovine bone matrix for controlled release of mesenchymal stem/stromal cell lyosecretome: A device for bone regeneration. Intl J Molec Sci 2021, 22, 4064.
Ultima modifica 14 Novembre 2022
Leggi anche
L’invasione silenziosa delle libellule migranti: lo spettacolo naturale che attraversa il Nord Italia
- Argomento
- Scienza e Tecnologia
Autore Giacomo Assandri
Data di pubblicazione
30 Agosto 2025
